Infections à staphylocoques
Infections à Staphylococcus aureus
Les staphylocoques sont des bactéries commensales de l'homme, avec 20 à 30% de la population présentant un portage nasal de Staphylococcus aureus. S. aureus est une bactérie pyogène et toxinogène, responsable de nombreuses infections communautaires et nosocomiales qui représentent un problème de santé publique. Elle provoque de nombreuses infections suppuratives dues à la multiplication de la bactérie et des infections toxiniques liées à la diffusion de toxines spécifiques.
Les infections suppuratives
On distingue les infections suppuratives superficielles et profondes qui impliquent la prolifération bactérienne, l'invasion, puis la destruction des tissus de l'hôte, la réponse inflammatoire locale et systémique.
S. aureus est principalement responsable d'infections suppuratives loco-régionales, cutanéo-muqueuses comme les folliculites, les furoncles, les panaris, l'anthrax, les cellulites, les sinusites et les otites.
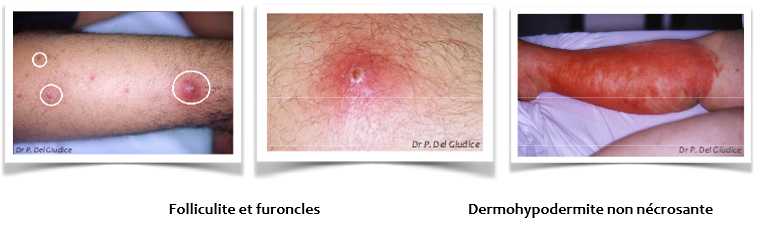
Ces infections se compliquent parfois par extension loco-régionale de l'infection, ou par diffusion hématogène de la bactérie. S. aureus peut alors être responsable d'infections profondes comme les septicémies, les endocardites, les pneumopathies, les ostéomyélites, les arthrites, les méningites et les infections urinaires.
Les infections toxiniques
Parmi les infections toxiniques, on distingue le choc toxique staphylococcique, le syndrome d'exfoliation généralisée, l'impétigo bulleux, la pneumonie nécrosante et les toxi-infections alimentaires.
- Le choc toxique staphylococcique : Le syndrome de choc toxique staphylococcique est provoqué par la diffusion dans l'organisme de la toxine TSST-1 et/ou des autres entérotoxines. La forme clinique complète de ce syndrome associe :
- une fièvre supérieure à 39°C,
- une hypotension artérielle,
- une érythrodermie scarlatiniforme généralisée suivie 7 à 14 jours après d'une desquamation intense,
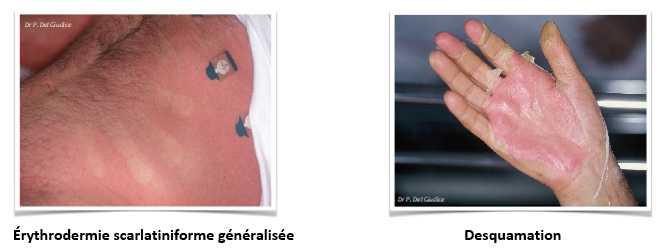
- et des manifestations systémiques (au moins trois)
- Digestives : vomissements, diarrhées
- Musculaires : myalgies, augmentation de la créatine phospho-kinase sérique
- Hyperhémies des muqueuses vaginale, oropharyngée, conjonctivale
- Rénales : hyperurémie, hypercréatininémie, leucocyturie sans infection urinaire
- Hépatiques : augmentation des transaminases
- Hématologiques : thrombopénie (< 100 000 plaquettes/mm3)
- Neurologiques : en dehors des épisodes de fièvre ou d'hypotension, troubles de type désorientation ou altération de la conscience.
La mortalité est de l'ordre de 10 %. Cette pathologie a initialement été décrite en pédiatrie comme une complication d'infection suppurative staphylococcique. Elle peut survenir sur une porte d’entrée correspondant à une infection suppurative ou un site de portage d’une souche productrice de super-antigène.
Parmi les chocs toxiques, on distingue les chocs toxiques menstruels pouvant survenir en cas de colonisation vaginale à S. aureus en période menstruelle chez les femmes avec un mésusage (port prolongé, mauvaise hygiène etc.) des tampons vaginaux hyper-absorbants ou des cups menstruelles. Cette étiologie est devenue exceptionnelle depuis la modification de la composition des tampons vaginaux. La recherche de la souche toxinogène est donc orientée par le contexte clinique du patient (foyer suppuratif, vagin, rhino-pharynx…).
A côté de cette forme classique, d'autres formes cliniques incomplètes sont décrites : la scarlatine staphylococcique, le NTED (Neonatal toxic shock syndrome-like Exanthematous disease) et le REDD syndrome (Recalcitrant Erythematous Desquamating Disorder).
- La scarlatine staphylococcique : caractérisée par une fièvre et un érythème scarlatiniforme typique en 48 heures suivi d'une fine desquamation, sans choc ni défaillance multi-viscérale.
- Le NTED : caractérisé par la survenue lors de la période néonatale d'une fièvre, d'une éruption cutanée et d'une thrombocytopénie (en l'absence de choc et d'autre signe de défaillance multiviscérale).
- Le REDD : syndrome qui a été observé initialement chez les patients sidéens, chez qui les lésions scarlatiniformes extensives chroniques sont associées à une défaillance multiviscérale mais sans état de choc.
- Les syndromes staphylococciques cutanés bulleux : provoqués par les toxines exfoliatines A ou B, on les distingue de la nécrolyse épidermique d'origine toxique ou allergique. En effet, le décollement cutané provoqué par les exfoliatines crée un plan de clivage intra-épidermique tandis que le plan de clivage d'origine toxique et allergique se fait entre le derme et l'épiderme au niveau de la couche basale.
- Le syndrome d'exfoliation généralisée : le syndrome de la peau ébouillantée chez les jeunes enfants (Staphylococcal Scalded Skin Syndrome, SSSS) est provoqué par la diffusion d'exfoliatines à partir d'un foyer de colonisation ou d'infection à S. aureus (foyer initial ORL, conjonctival ou cutané). Ce syndrome est appelé syndrome de Ritter chez les nouveau-nés. Il se rencontre dans la grande majorité des cas chez le jeune enfant mais peut aussi se rencontrer chez l'adulte immunodéprimé et les patients atteints d'insuffisance rénale. Les symptômes débutent par un rash scarlatiniforme douloureux (surtout visage, plis et régions péri-orificielles) qui est suivi en quelques heures d'un décollement spontané ou provoqué (signe de Nikolski). Le contenu des bulles est clair et stérile (en l'absence de surinfection).
La recherche de la souche toxinogène doit être faite au niveau du rhino-pharynx ou d'un site d'infection en cas de signes cliniques évocateurs d'une infection suppurative. L'évolution bénigne, favorisée par un traitement antibiotique, ne doit pas faire oublier le risque d'évolution mortelle estimé à environ 4% en cas de retard de traitement antibiotique.
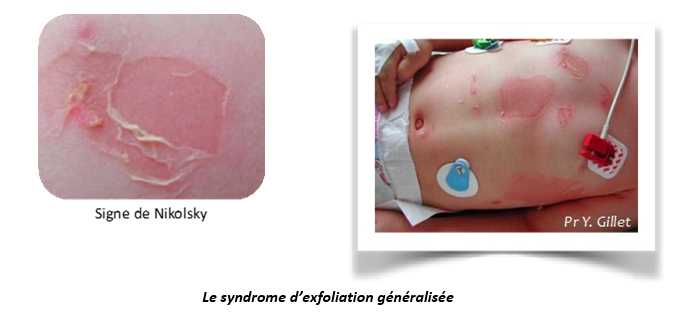
- Le mild SSSS est une forme mineure de la maladie exfoliante généralisée caractérisée par un exanthème desquamatif du cou, des plis axillaires et périnéaux, un syndrome fébrile et un impétigo facial, et est associé à des souches porteuses d’exfoliatines.
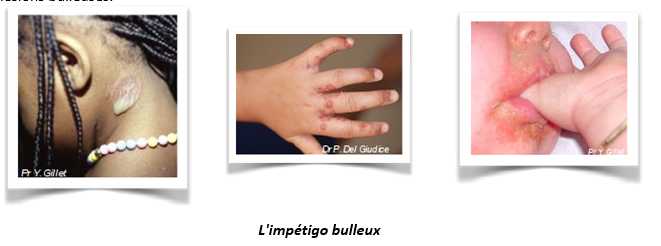
- L'impétigo bulleux : par opposition au SSSS, l'impétigo bulleux est induit par des souches de S. aureus productrices d'exfoliatines A et/ou B au sein même des lésions cutanées. Il est constitué d'un nombre variable de bulles prédominantes aux extrémités, à contenu trouble, contenant le staphylocoque et la toxine (exfoliatine). Les bulles évoluent vers l'ouverture et la formation d'ulcérations puis de croûtes. La recherche de la souche toxinogène doit être faite au niveau des lésions bulleuses.
- La pneumonie nécrosante : associée à des souches de S. aureus producteur d'une cytotoxine, la leucocidine de Panton Valentine (PVL), elle touche principalement les enfants et les jeunes adultes, sans antécédent particulier. Dans la moitié des cas, la pneumonie est précédée d'un syndrome grippal, avec pour certaines observations l'isolement d'un virus de type influenza. Les autres particularités sont la survenue d'une pneumonie sévère rapidement progressive, avec détresse respiratoire, atteinte pleurale, leucopénie et hémoptysies. Malgré l'antibiothérapie adaptée, la mortalité est très lourde, environ 60% (Gillet Y et al., Eur Respir J. 2021).
- L'intoxication alimentaire survient après l'ingestion d'entérotoxines thermostables préformées dans les aliments contaminés par S. aureus producteur d'entérotoxine. Elle se traduit cliniquement par une incubation courte (1 à 6 heures après ingestion), puis des nausées, des vomissements, des crampes abdominales, des diarrhées et l'absence de fièvre. L'évolution est le plus souvent spontanément favorable sans traitement. La recherche de souche toxinogène et des entérotoxines doit être réalisée dans l'aliment ou dans les vomissements des patients et non dans les selles.
Intoxination
Un foyer de toxi-infections alimentaires collectives (TIAC) se définit par l’apparition d’au moins deux cas groupés similaires d’une symptomatologie en général digestive, dont on peut rapporter la cause à une même origine alimentaire. La première description d’intoxication alimentaire liée à S. aureus date de 1884 dans le Michigan, par Vaughan et Sternberg (Hennekinne et al., FEMS Microbiol Rev 2012). L’incubation de 30 minutes à 8 heures (3 heures en moyenne) est suivie de vomissements, crampes abdominales douloureuses, diarrhées, sans fièvre. Les cas sévères s’accompagnent d’hypotension artérielle, de déshydratation, et peuvent nécessiter une hospitalisation. Des cas de décès ont été recensés de façon exceptionnelle (taux de mortalité de 0,02%). L’évolution est le plus souvent spontanément favorable en 8 à 24 heures après le début des symptômes. Aucune transmission inter-humaine n’a été décrite. Cette entité clinique correspond à l’ingestion d’entérotoxines de S. aureus, présentes dans de la nourriture contaminée par des souches entérotoxinogènes. La toxine le plus souvent en cause est l’entérotoxine A, seule ou associée (Wieneke et al., Epidemiol Infect. 1993).
En 2021, l’agent pathogène le plus fréquemment confirmé sur le plan microbiologique était Salmonella pour 44% des TIAC à agent confirmé. Les agents pathogènes les plus couramment suspectés, sur la base des informations épidémiologiques et cliniques, mais sans pouvoir être confirmés sur le plan microbiologique, étaient les agents toxiniques Staphylococcus aureus, Clostridium perfringens et Bacillus cereus correspondant à 67% des TIAC pour lesquelles un agent a été suspecté (données SpF 2021, lien : https://www.santepubliquefrance.fr/content/download/537274/3924609?version=1).
Les sources alimentaires les plus à risque sont celles nécessitant de multiples manipulations humaines (plats cuisinés, salades composées, gâteaux à la crème) ou les aliments recontaminés après préparation et rupture de la chaîne du froid (jambon, fromages, mayonnaise, etc.) (Hennekinne et al., FEMS Microbiol Rev 2012).
Seule la détection directe des toxines dans l’aliment contaminant et les rejets alimentaires (vomissures) est utile à l’enquête épidémiologique.
Liens utiles
- Modalités d'envoi au CNR
- Fiche ANSES : "Staphylococcus aureus et entérotoxines staphylococciques"
- Laboratoire National de Référence Staphylocoques à coagulase positive y compris Staphylococcus aureus et entérotoxines staphylococciques
- Toxi-infections alimentaires (Santé publique France)
Infections à Staphylococcus non-aureus
La majorité des staphylocoques non-aureus sont des bactéries opportunistes essentiellement responsables d'infections nosocomiales. Trois facteurs favorisent ces infections : l'immunodépression, la présence de cathéters veineux ou de matériaux prothétiques, la multirésistance des staphylocoques non-aureus aux antibiotiques. S. epidermidis est l'espèce la plus fréquemment isolée en milieu hospitalier.
S. epidermidis peut provoquer des infections chez les sujets porteurs de matériel étranger (cathéters intravasculaires, prothèses ostéo-articulaires, boîtiers de stimulation cardiaque, valves de dérivation du liquide céphalo-rachidien). S. epidermidis est aussi responsable de septicémies notamment dans les services d'oncologie et de néonatologie, de péritonites chez les patients en dialyse péritonéale, d'endocardites surtout chez les sujets porteurs de prothèse valvulaire cardiaque, d'infections sur valve de dérivation du liquide céphalo-rachidien ou sur matériel orthopédique.
S. haemolyticus est la seconde espèce responsable d'infections humaines, en particulier de suppurations, d'infections urinaires et de septicémies. Au cours de l’année 2022/2023, une épidémie d’infections précoces à S. haemolyticus a été signalée dans les services de néonatalogie en France.
Au sein des Staphylocoques non-aureus, deux espèces sont responsables d'infections communautaires : S. saprophyticus provoque des cystites chez les jeunes femmes et S. lugdunensis est responsable d'infections cutanées et d'endocardites infectieuses.
Chez les grands prématurés, les septicémies nosocomiales sont fréquentes et potentiellement sévères. Une souche particulière de Staphylococcus capitis (appelée clone NRCS-A) est impliquée spécifiquement dans ces infections, et il a été démontré : i) sa diffusion mondiale spécifiquement en réanimation néonatale, ii) son caractère multirésistant aux antibiotiques, iii) sa présence (colonisation) fréquente dans les selles des prématurés hospitalisés ainsi que sa résistance à la nisine, une bactériocine produite dans le microbiote digestif, suggérant que la physiopathologie des infections à NRCS-A pourrait reposer sur une translocation à travers la barrière digestive, iv) sa capacité à persister dans l’environnement des services de réanimation néonatale, notamment au niveau des couveuses.
Physiopathologie de S. aureus
Le pouvoir pathogène de S. aureus est lié à l'expression de facteurs de virulence. On distingue les protéines de surface (adhésines) qui permettent la colonisation de l'hôte, des facteurs qui conduisent au développement et à l'extension de l'infection et des toxines spécifiques responsables de syndromes toxiniques.
Protéines de surface : colonisation
S. aureus colonise la peau et les muqueuses en adhérant aux cellules et aux composants de la matrice extra-cellulaire. La colonisation s'observe en dehors de toute lésion préalable. Elle est cependant favorisée par toute effraction de la barrière cutanéo-muqueuse.
S. aureus possède un grand nombre de protéines exposées à la surface de la bactérie, qui ont la capacité de se fixer sur des molécules de l'hôte. On parle d'adhésines. Un certain nombre de ces adhésines appartiennent à la famille des MSCRAMM (Microbial Surface component Recognizing Adhesive Matrix Molecule) c'est-à-dire qu'elles reconnaissent les molécules de la matrice extra-cellulaire, composée de collagène, d'élastine, de protéoglycanes et de glycoprotéines de structure telles que la fibronectine.
Parmi ces protéines, les mieux caractérisées sont
- La protéine A,
- La protéine de liaison au collagène de type I, II et IV,
- Les protéines de liaison à la fibronectine,
- Les protéines de liaison au fibrinogène- Clumping factor.
Facteurs protégeant la bactérie de la phagocytose
Quatre-vingt-dix pour cent des souches cliniques de S. aureus produisent une capsule composée d'exopolysaccharides qui, avec la protéine A, protègent la bactérie de la phagocytose, favorisant ainsi l'extension de l'infection.
La coagulase se lie à la prothrombine et forme un complexe appelé staphylothrombine. Le complexe staphylothrombinique entraîne la polymérisation du fibrinogène en fibrine et la formation d'un caillot, protégeant ainsi la bactérie de la phagocytose.
Facteurs conduisant à l'extension de l'infection
Extension
S. aureus produit plusieurs toxines ayant pour cible les membranes cellulaires (pore-forming toxins). Ces toxines se fixent à des cellules cibles de l’hôte et provoquent la formation de canaux membranaires qui entrainent la perte de son intégrité et provoquent une fuite des composés intracellulaires tels que les ions et l’eau menant à la lyse cellulaire. On peut citer les hémolysines α, β, δ, les phenol-soluble modulins et les toxines synergohyménotropes.
Les autres enzymes produites par S. aureus capables de dégrader le tissu conjonctif comme les protéases, l'élastase et la hyaluronidase, favorisent l'extension du foyer infectieux.
Diffusion hématogène
La diffusion hématogène de S. aureus à partir du foyer primaire se fait probablement par le biais de thrombophlébites locales où la coagulase joue un rôle majeur. La coagulase se lie à la prothrombine et forme un complexe appelé staphylothrombine. Ce complexe staphylothrombinique entraîne la polymérisation du fibrinogène en fibrine et ceci aboutit à la formation de thrombus. La staphylokinase, activateur du plasminogène en plasmine exerce un effet inverse à celui de la coagulase. Elle conduit à la dislocation du thrombus qui est très riche en bactéries et ainsi à la formation de localisations septiques secondaires.
Toxines
Exfoliatines
Les exfoliatines A et B, et probablement C, sont à l'origine du syndrome d'exfoliation généralisée et de l'impétigo bulleux staphylococcique. Le mécanisme d'action de ces toxines protéiques au niveau de l'épiderme n'est pas complètement élucidé. Il fait initialement intervenir un élargissement de l'espace intercellulaire, puis un clivage des desmosomes reliant les cellules granuleuses de l'épiderme, probablement par l'activation d'une pro-enzyme extracellulaire (protéase) par les exfoliatines.
Toxines superantigéniques
Les toxines staphylococciques ayant une activité superantigénique sont : la toxine du choc toxique staphylococcique (TSST-1), les entérotoxines A à E, G, et I à U. D'autres bactéries produisent des toxines superantigéniques, notamment Streptococcus pyogenes (toxines érythrogènes SpeA, SpeB, SpeC…, toxine SSA, probablement la protéine M), Streptococcus agalactiae (toxine non caractérisée), Pseudomonas aeruginosa (exotoxine A) …
Les superantigènes sont un groupe de molécules capables de provoquer une activation polyclonale des lymphocytes T. Pour cela, ils se fixent directement aux cellules présentatrices d'antigènes, par deux liaisons au niveau de l'antigène de classe II du complexe majeur d'histocompatibilité (CMH II) en dehors du site de fixation classique des antigènes. Les superantigènes sont alors reconnus par les lymphocytes T. Cette reconnaissance se fait par une liaison de la chaine Vß du récepteur lymphocytaire TCR2 des cellules CD4+ ou CD8+ (fixation sur les régions constantes de certains types de chaîne Vß).
Cette fixation sur la chaîne Vß est alors suffisante pour induire une activation cellulaire. Ainsi, 5 à 50% des lymphocytes T sont concernés et sont activés indépendamment de leur spécificité antigénique, ouvrant la possibilité :
o d'une activation massive du système immunitaire, avec libération de cytokines de l'inflammation et survenue du choc toxique.
o d'une activation parasite des lymphocytes dirigés contre des antigènes du « soi » et ainsi la possible survenue de réaction auto-immune. En effet, les toxines staphylococciques à activité superantigéniques telles que les entérotoxines et la toxine du choc toxique staphylococcique (TSST-1) ont été impliquées dans la survenue de maladies de type auto-immun comme la maladie de Kawasaki, la dermatite atopique, le psoriasis et certaines arthrites rhumatismales. Le rôle exact de ces toxines dans ces pathologies n'est pas encore clairement établi. Elles pourraient être soit un facteur étiologique, soit un cofacteur favorisant la survenue de poussées évolutives.
Leucocidine de Panton Valentine PVL
La Leucocidine de Panton Valentine ou PVL est une toxine à deux composants agissant de façon synergique sur les membranes cellulaires (toxine synergohyménotrope) appartenant à la famille des pore-forming toxins. In vitro, la PVL induit la lyse de plusieurs types cellulaires participant aux défenses de l'hôte comme les polynucléaires neutrophiles, les monocytes, et les macrophages. La formation d'un pore dans la membrane cellulaire requiert la présence des deux composants de la toxine, LukS-PV et LukF-PV. Les concentrations sublytiques de PVL induisent une libération massive d'histamine par les polynucléaires basophiles et stimulent la libération par les polynucléaires neutrophiles d'enzymes (bêta-glucuronidase et lysozyme), composés chimiotactiques (leucotriène-B4 et interleukine-8) et des métabolites oxygénés. LukS-PV et LukF-PV sont codés par des bactériophages d'environ 50 kb dont le prototype est phi SLT, qui est présent dans moins de 3% des souches de S. aureus isolées dans les pays développés. Les souches de S. aureus portant phi SLT (ou d'autres bactériophages similaires codant lukS-PV et lukF-PV) sont classiquement associées aux infections cutanées primitives comme les furoncles, volontiers récidivantes.
