IMMUNORARE5, un projet de recherche ambitieux en faveur des cancers rares
Pour que les cancers rares profitent aussi des avancées de la recherche en cancérologie
Depuis plusieurs années, nous assistons à des avancées thérapeutiques majeures dans la prise en charge des cancers. L’immunothérapie vise à stimuler les défenses immunitaires de notre propre organisme contre les cellules cancéreuses, permettant de modifier profondément le pronostic, voire les chances de guérison des patients. Grâce aux résultats positifs de grands essais cliniques dédiés aux cancers les plus fréquents, l'immunothérapie fait aujourd'hui partie des stratégies standards de traitement des cancers du sein, du tube digestif, du rein, de la vessie, des poumons ou de la peau, avec un impact significatif sur l'espérance de vie des patients.
Les cancers rares représentent 22% de l’ensemble des cancers identifiés dans l’Union Européenne et près de 30% des décès liés aux cancers. Leur traitement constitue un enjeu majeur de la cancérologie dans les années à venir. Cependant, du fait de leur rareté, de leur méconnaissance, des difficultés diagnostiques et de la priorité donnée aux cancers plus fréquents pour le développement de thérapies innovantes, les patients atteints de cancers rares sont malheureusement souvent tenus à l'écart des progrès et restent majoritairement traités par chimiothérapie classique.
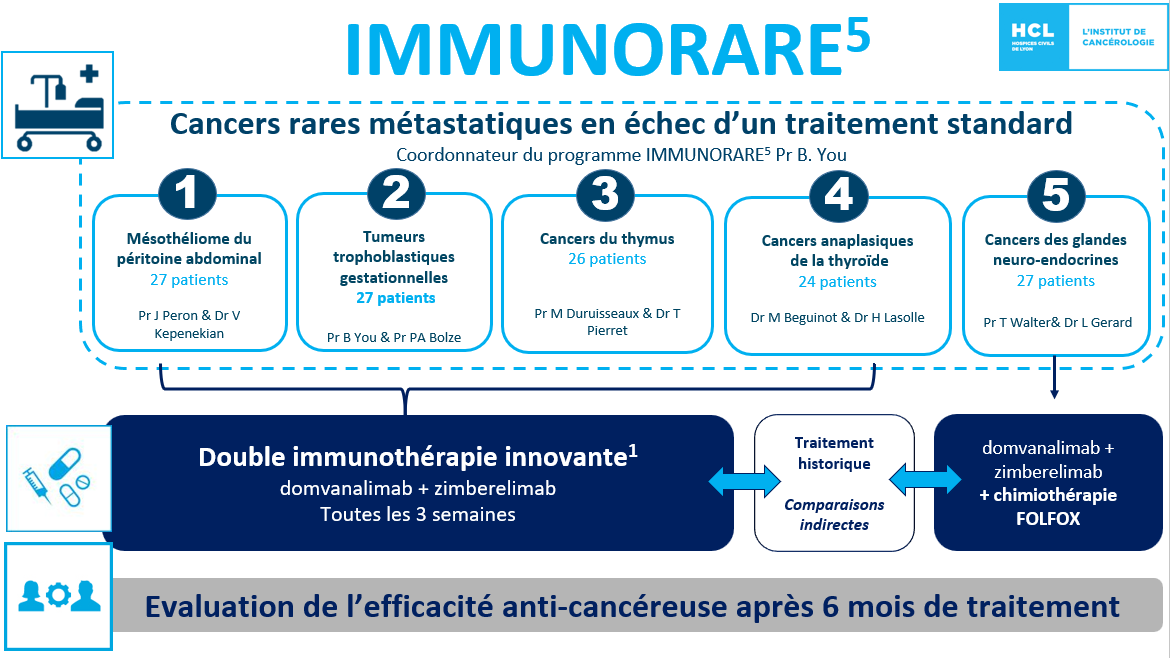
Le programme IMMUNORARE5 a pour objectif d’évaluer la place d’une double immunothérapie innovante chez des patients atteints de cancers rares, afin d'investiguer son efficacité et sa tolérance, et en cas de succès, de pouvoir rapidement, la mettre à disposition du plus grand nombre. L’inclusion du premier patient est attendue pour le printemps prochain.
« Avec les collègues impliqués dans la prise en charge du cancer, nous voyons tous les jours les progrès thérapeutiques à base d’immunothérapie chez des patients atteints de cancers fréquents (sein, colon-rectum, poumon …). Il était devenu indispensable que nous trouvions une solution pour que ces progrès puissent profiter à tous, y compris aux patients atteints des cancers les plus rares. Cela a été notre première motivation pour concrétiser cet ambitieux programme. » Pr Benoit YOU, responsable du centre d’essais cliniques de phase précoce des HCL (EPSILyon) et porteur du programme IMMUNORARE5

Kick-off meeting MMUNORARE5 - 2024
Un programme d’envergure nationale au design innovant…
IMMUNORARE5 est une étude multicentrique à promotion HCL d’envergure nationale, visant à étudier l’efficacité d’une double immunothérapie innovante et prometteuse (domvanalimab + zimberelimab , ayant déjà obtenu des résultats encourageants pour les cancers bronchiques ou gastriques), auprès de cinq cohortes de patients atteints de cancers rares, en échec thérapeutique :
- Mésothéliomes du péritoine (cancer de l’enveloppe entourant les organes de l’abdomen)
- Tumeurs trophoblastiques gestationnelles (cancer du placenta survenant durant la grossesse)
- Cancers du thymus (glande située dans la partie supérieure du thorax)
- Cancers réfractaires de la thyroïde
- Tumeurs neuroendocrines (tumeurs des glandes hormonales au sein des organes)
1 Médicaments en cours de développement ne disposant d’aucune autorisation de mise sur le marché en Europe.
L’étude IMMUNORARE5 durera 6 ans : la phase d’enrôlement des patients dans l’essai durera 3 ans, suivie d’une période de traitement et de suivi des patients inclus de 3 ans supplémentaires. Le traitement de double immunothérapie sera administré à l’hôpital sur une durée de quelques heures, toutes les 3 ou 4 semaines en fonction de la cohorte. Au total, 131 patients seront inclus dans le programme IMMUNORARE5 et traités au sein de 15 centres français impliqués dans la prise en charge de ces cancers rares et capables de réaliser des essais de phase précoce. Chacun des cinq essais sera mené de façon indépendante avec un binôme de médecins issu des Hospices Civils de Lyon, comprenant des experts en essais cliniques innovants et des spécialistes des maladies concernées au sein des centres de référence nationaux des cancers rares concernés. Ces essais seront conduits avec une coordination opérationnelle centralisée par l’équipe du centre de phase précoce CLIP2 des HCL (EPSILyon) labellisé INCa, sous la supervision du Pr Benoit YOU, oncologue médical aux HCL. C’est le taux d’efficacité du traitement à 6 mois qui sera évalué en première intention. Des résultats positifs seraient une source d’espoir pour les patients en situation d’impasse thérapeutique.
« Dans les mésothéliomes du péritoine, nous manquons cruellement d’options de traitement lorsque la maladie rechute après une opération et chimiothérapie standard. Le projet IMMUNORARE5 est porteur d’un réel espoir pour nos patients. » Dr Vahan KEPENEKIAN, Chirurgien au Centre de référence des maladies du péritoine RENAPE et co-coordonnateur de la Cohorte 1 sur les mésothéliomes
S’il s’agit d’un essai clinique académique conçu et dirigé par les médecins-chercheurs des HCL avec l’aide de scientifiques du programme EPSILyon et des méthodologistes du CHU, sa réalisation implique la participation de nombreux professionnels de spécialités différentes, tels que les attachés de recherche clinique, les infirmiers de recherche, les biologistes, les radiologues, les juristes et les financiers,…, et bien sûr les pharmaciens dont le rôle est primordial.
« Le programme IMMUNORARE5 demande aux pharmaciens une implication extrêmement pointue, afin d’organiser l’importation des médicaments à partir des Etats-Unis, leur conditionnement et leur distribution auprès des centres recruteurs français dans le respect de la réglementation et des règles de sécurité pour les patients » Dr Vérane SCHWIERTZ, Pharmacien responsable des aspects pharmaceutiques de IMMUNORARE5
Sur le plan financier, IMMUNORARE5 repose sur une collaboration publique-privée forte. Un partenariat a été contractualisé entre les HCL et le laboratoire Gilead Sciences ; il permet un soutien de l’étude et la mise à disposition des traitements pour l’ensemble des cinq cohortes.
« En rassemblant les compétences d’experts pluridisciplinaires, de médecins-chercheurs, de méthodologistes, d’attachés de recherche clinique, et l’expérience d’un industriel autour d’un domaine complexe et parfois délaissé par la recherche que sont les cancers rares, IMMUNORARE5 représente à la fois un beau défi et un exemple en matière de collaboration publique-privée, qui correspond pleinement à la façon la plus moderne de faire de la recherche, en lien avec la politique d’alliance des Hospices Civils de Lyon. » Alexandre PACHOT, Directeur de la Recherche en Santé des HCL
« Le laboratoire Gilead Sciences est fier de soutenir le projet d’envergure nationale IMMUNORARE, piloté par les Hospices Civils de Lyon, alliant l’innovation du design de l’étude à celle des thérapies, au service des cancers rares, pour lesquels il subsiste encore un fort besoin médical non couvert. » Dr Afifa LAHRACHE, Directrice Médicale Oncologie, Gilead Sciences France
Afin de compléter les résultats cliniques que le programme IMMUNORARE5 générera, un groupe de travail scientifique coordonné par le Pr Michael Duruisseaux - pneumologue à l’hôpital Louis Pradel des HCL, directeur médical de l’Institut de cancérologie des HCL, co-coordinateur de la Cohorte 3 d’IMMUNORARE5 sur le cancer du Thymus et chercheur au Centre de Recherche en Cancérologie de Lyon (CRCL) - développera des projets de recherche translationnelle connexes. Le but : trouver des biomarqueurs susceptibles de prédire l’efficacité du traitement et ainsi aider à mieux sélectionner les patients à l’avenir. Un autre axe de recherche visera à comparer ces données d'efficacité à celles des chimiothérapies historiques renseignées dans les registres nationaux.
… Qui s’appuie sur l’excellence des HCL en matière de phases précoces et de tumeurs rares
Cette étude est rendue possible grâce à la double expertise des HCL en matière de :
- Prise en charge des cancers rares
Les Hospices Civils de Lyon comptent plusieurs centres de référence nationaux pour la prise en charge des cancers rares, labellisés par l'Institut National du Cancer (INCa), qui profitent de l'expertise et du recrutement de ces patients, tels que le centre de référence pour les mésothéliomes péritonéaux (cancer des enveloppes des organes de l'abdomen), des tumeurs trophoblastiques gestationnelles (cancer du placenta à l'occasion d'une grossesse), des tumeurs rares du thorax, des cancers endocriniens (organes des hormones), ou encore des tumeurs neuroendocrines.
- Réalisation d’essais de phases précoces
Les HCL disposent d’un centre spécialisé pour la réalisation des essais cliniques dits de phase précoce, labellisé par l’INCa disposant de toutes les capacités techniques et humaines permettant de conduire des études thérapeutiques au niveau local ou national.
En 2010, le centre de recherche contre le cancer de l’hôpital Lyon Sud des HCL faisait partie de la toute première liste d’établissements français à obtenir le label CLIP² de l’INCa, visant à soutenir les essais de phase précoce des nouvelles thérapies.
Pour son quatrième renouvellement pour la période 2025-2030, le label s’est étendu d’une part aux hôpitaux cardiologique Louis Pradel et neurologique Pierre Wertheimer des HCL, avec l’ouverture d’une nouvelle unité de phase précoce sur leur site du groupement hospitalier Est, et d’autre part au CHU de Saint-Etienne, sous le nom EPSILyon (pour Early Phase Studies in Lyon).
C’est quoi un essai de phase précoce ?
Les essais de phase précoce regroupent les essais de phase 1 et de phase 2, correspondant le plus souvent à la première administration d'un médicament à l'homme. Ils permettent une première évaluation de l’efficacité de la molécule ou de la combinaison de molécules testées, ainsi que de sa sécurité d’emploi et les effets indésirables liés.
